قانون شارل
ژاک الکساندر سزار شارل یکی از معروفترین ریاضیدانان و شیمیدانان فرانسوی است
ژاک شارل فيزيکدان فرانسوی درسال ۱۷۸۷ ميلادی به رابطه اثر دما برحجم گاز ها درفشار ثابت پی برد.
اوباانجام آزمايش برروی گازهای متفاوت وبامقادير مختلف دريافت،که براثرتغيير دما به اندازه يک درجه سيليسيوس ، حجم گازها به اندازه ۲۷۳/۱ برابرحجم آن گاز در دمای صفردرجه سيليسيوس (oC) تغيير می يابد. قانون شارل را می توان دررابطه زير خلاصه نمود .
اگر نمودار تغييرات حجم گازهارا برحسب تغييردما (برحسب oC ) رسم نمايید خطوط راستی به دست
خواهد آمد که اگرآنها را ادامه دهيد ( برون يابی ) ،مشاهده خواهد کرد که همگی محورافقی را در
(-273 c ) قطع خواهند نمود . لرد کلوين - دانشمند انگليسی پنجاه سال بعد از شارل اين دما را صفر مطلق ناميد.اين يافته ها می رساند که در( ۲۷۳-) درجه سيلسيوس گاز حجمی ندارد،و يا ناپديد خواهد شد اما تمام گازها قبلا از رسيدن به اين دما مايع می شوند و رابطه شارل برای مايعات وجامدات صدق نمی کند.
اگردما را برمبنای اين نقطه بسنجيم مقياس جديدی به دست می آيد که به احترام لرد کلوين، کلوين ناميده شده وبا حرف K نشان داده می شود. t(0 C) +273 =K
طبق قانون شارل ،حجم يک مقدار معين گاز با دمای مطلق به طور مستقيم تغيير می کند .
V = k T
ومی توان نتيجه گرفت . V1 / T1 = V2 / T2
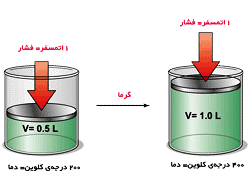
سوال: چنانچه در فشار ثابت 500 سانتی متر مکعب گاز نیتروژن را از دمای 54 درجه سانتی گراد به 100 درجه برسانیم حجم آن چه تغییری خواهد کرد؟



 راه اندازی سایت hichem.ir
راه اندازی سایت hichem.ir